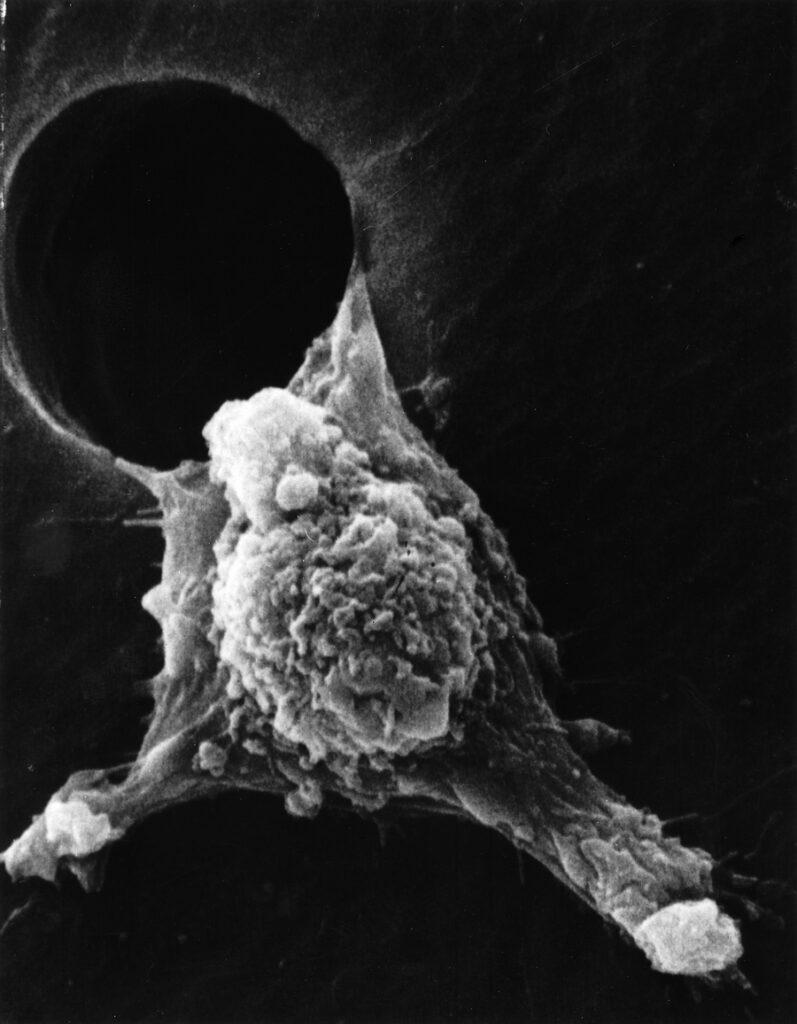
(Na slici: ćelija raka puzi iz limfnog otvora. Ovakve ćelije se kreću od početnih tumora i izazivaju metastaze, nova žarišta raka u telu. Izvor: NCI, Dr. Raouf Guirgus. Fotografija: Susan Arnold)
Per nekoliko nedelja, vodio sam diskusiju o radioaktivnosti u grupi “Nauka.” U toku te diskusije, postalo je očigledno da postoji značajan nivo nerazumevanja povodom mnogih centralnih aspekata ćelijske biologije, pre svega povodom pitanja kako nastaje rak. Ljudima je bilo nejasno kako izlaganje kancerogenoj supstanci povećava verovatnoću raka godinama ili decenijama kasnije; neki od sagovornika su bili ubeđeni da genetski oštećene ćelije umiru, ili da bivaju zamenjene, i da otud bolest mora da se javi odmah ili nikada.
Ovo su važna pitanja koja vredi razumeti. Tekst koji sledi je dugačak, jer pokušava da sažme predmete koji bi se inače detaljno učili kroz više semestara; ali nadam se da je čitljiv, i da može da da osnovno razumevanje ove teme ljudima sa svim nivoima obrazovanja. Imajte da u vidu da su mnoge stvari u tekstu VRLO uprošćene, i da se preskače ogroman broj komplikacija i detalja; ali bez toga ne bi bilo moguće napisati ovo uopšte.
Kako se ćelije dele?
Ćelije u telu odrasle osobe spadaju, vrlo grubo rečeno, u dve kategorije.
Prvo, imate takozvane post-mitotičke ćelije, kao što su neuroni ili ćelije srčanog mišića. Ovakve ćelije prestaju da se dele kada postignu svoj konačni oblik, i generalno traju do kraja života. Neuroni u vašem mozgu i mišićne ćelije koje pulsiraju u vašem srcu su iste ćelije koje ste imali nakon odrastanja, i možete da se nadate da će većina njih preživeti do kraja vašeg života.
Post-mitotičke ćelije efektivno nikada ne mogu da postanu kancerozne: pošto se nikada ne dele, njihova deoba ne može da postane nekontrolisana. Ali generalno, kada ih izgubite, izgubili ste ih, ne mogu da se vrate. Ako vam deo srčanog mišića odumre, to oštećenje ostaje tu, ne oporavlja se značajno.
Drugo, imate ćelije koje se dele. Ove ćelije čine najveći deo tkiva u telu, i uprošćeno (i preskačući razne komplikacije), proces je jednostavan: majka ćelija se deli na dve ćerke-ćelije. Onda se te ćerke-ćelije dele, i proizvode četiri potomka. I tako iz generacije u generaciju. Svaka deoba se sastoji od kopiranja DNK, i podele materijala unutar ćelije. Veoma bitno za poentu ovog teksta, sve mutacije u DNK se takođe prenose na ćerke.
Uzmite čoveka koji se posekao nožem. Sam nož uništi ćelije u centralnom delu posekotine. Oko tih ćelija su mnoge druge koje budu katastrofalno oštećene izlaganjem vazduhu i mikroorganizmima koji prodru do njih kroz posekotinu. Imuni sistem brže-bolje uništi sve ćelije koje su značajno povređene, pobije mikroorganizme, a krv se zgruša i prekrije ranu da spreči dalju infekciju.
Onda se ćelije iz okolnog tkiva dele: epitelijalne ćelije se dele da popune prostor koji je sada otvoren. Ćelije krvnih sudova u okolini se sa ivica rane počnu da se dele da obnove uništenu mrežu kapilara. Imune ćelije se dele lokalno da bi proizvele “gardu” koja štiti od ostataka infekcije, i koja pomaže da se raščiste ostaci uništenog tkiva. Itd.
Čak i kod relativno malih povreda, ovim procesom od desetina hiljada ćelija nastaju milioni.
Ćelije takođe imaju životni vek i umiru prirodno. Ovo se obično događa “uredno,” kroz proces koji se zove “apoptoza,” u kome ćelija spakuje samu sebe u grudvice materijala okruženog membranama – koje onde druge ćelije mogu da razlože (efektivno, pojedu). Ali može da se desi prosto raspadom sistema (što se obično zove nekroza ćelije).
Ali pitanje životnog veka je ovde malkice komplikovano, jer ne gledamo prosto jednu ćeliju koja stari i umire.
Umesto toga, imate jednu ćeliju. Ona se podeli na dve. Od te dve, jedna zakači neki virus i umre. Ona druga se opet podeli na dve. Te dve se podele na četiri, od kojih jedna nasledi višak oštećenih i starih proteina. Ta koja ima ta nakupljena oštećenja onda umre zato što su joj delovi postali stari. I kažemo, eto, umrla je od starosti. Ali… u tkivu i dalje imamo tri kopije te iste ćelije. Iako je jedan potomak umro “od starosti,” drugi su tu. I i dalje se dele, i proizvode dalje potomke.
Ćelije pokušavaju da se podele bez greške, i postoji niz sistema koji kontrolišu svaki aspekt podele. Ali ovi sistemi nisu savršeni: ljudski genom, sa svojih tri i kusur milijardi DNK “slova,” stiče oko deset novih grešaka u svakoj podeli. Te greške budu nasleđene od strane sledeće generacije ćelija. Kada se one zatim podele, unosi se deset novih grešaka. Itd.
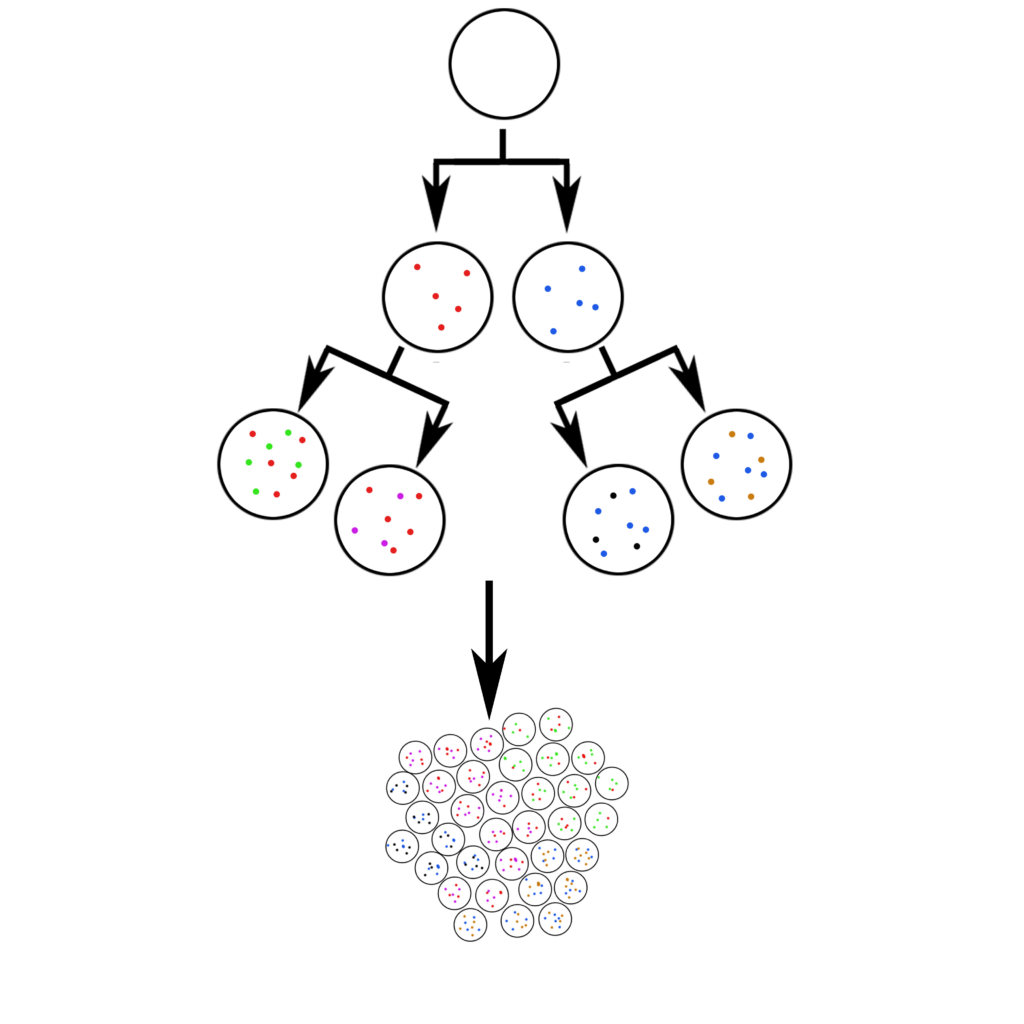
Ljudsko telo sadrži desetine triliona ćelija. Svaki dan, u organizmu se deli oko dva triliona ćelija. Što znači da svaki dan, prosečni čovek doživljava oko dvadeset triliona novih mutacija. Ljudski genom sadrži 3.2 milijarde slova – mada je u stvari to 6.4, jer imamo dve kopije po ćeliji. Ovo znači da ako izaberete jedno određeno “slovo” DNK, svaki dan možete naći oko tri hiljade novih ćelija u kojima je baš to određeno slovo mutiralo.
Kako vrsta može da opstane uopšte, i kako naše telo ostaje funkcionalno? Ovo su dva odvojena pitanja.
Vrsta opstaje zato što se semene ćelije, one koje prenose DNK sledećim generacijama, dele na načine koji ulažu ogromnu energiju da zaobiđu ovaj problem. Spermatozoidi nastaju tako što se ista ćelija deli asimetrično: u svakoj podeli, originalna ćelija ostaje, ali proizvodi jednu ćerku ćeliju sa kopijom DNK koja se zatim razvija u spermatozoid. Time se sprečava akumulacija novih grešaka, pošto se uvek kopira isti početni “tekst.” Ovo nije savršen proces: mutacije se i dalje akumuliraju, i deca starijih očeva nose mnogo više naslednih mutacija nego deca mlađih očeva.
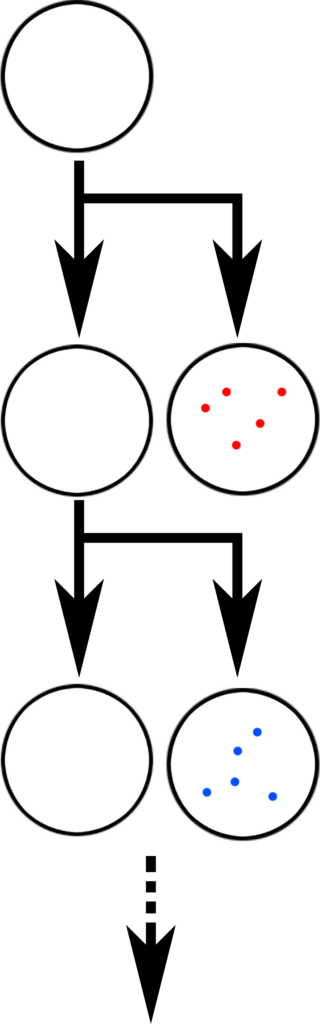
U slučaju jajnih ćelija, proces je još ekstremniji: jajne ćelije se proizvode u toku embrionalnog razvoja, i onda prestaju da se razmnožavaju; devojčice se rađaju sa svim jajnim ćelijama koje će ikada imati, i ne proizvode nove. Te jajne ćelije takođe prolaze kroz veoma tešku “kontrolu kvaliteta,” u kojoj bivaju izložene visokom nivou unutrašnje metaboličke aktivnosti; većina ih odumre tokom ove kontrole, i samo mali broj ostaje za ostatak života.
Ali čak sa svime time, broj grešaka je toliki da se konačni korak uklanjanja grešaka događa tek nakon oplodnje: zbog genetskih problema i kvarova, oko polovine oplođenih ljudskih embriona umire pre nego što dođe do materice, a preko polovina onih koji ne umru odmah bude odbačena u toku prvih nedelju ili dve trudnoće (obično pre nego što žena i zna da je zatrudnela). Manje od 25% embriona ima dovoljno “genetskog zdravlja” da bi dobilo čak i šansu da uopšte bude rođeno! Svi genetski defekti za koje znate spadaju u ovu kategoriju: loši su, ali su i dalje u najboljih 25% po ukupnom kvalitetu.
Tako opstaje vrsta. A kako mi preživljavamo kao organizam? Pa, osnovni odgovor na to pitanje je da ne preživljavamo: ovo nakupljanje genetskih grešaka dovodi do procesa koga nazivamo “starenje,” koji na kraju dovede do raspada nekog od ključnih sistema, i do smrti. Najveći broj nas će umreti od direktnih ili indirektnih posledica ove akumulacije grešaka na raznim mestima u telu.
Ali postoje mehanizmi koji ovo ograničavaju. Ne, ne mehanizmi popravke DNK: ovde govorimo o greškama koje ostaju NAKON što ti mehanizmi urade sve što mogu da urade. Radi se o mnogo okrutnijim stvarima.
Prvo, zaista kritični sistemi nemaju mnogo tolerancije: mutacije koje pogode baš katastrofalnu tačku (recimo, mnoge mutacije u histonima) dovode do ekspresne smrti mutirane ćelije, što sprečava da se ona dalje deli i da njeni potomci dalje prenose takvu veliku grešku. Drugo, tako što naše ćelije imaju ogroman broj redudantnih sistema: za sve što se pokvari, ima nekoliko drugih sistema koji mogu da obave isti ili sličan posao. Manje efikasno, ali mogu.
Ako uzmete ćelije iz nekog vašeg tkiva, naćićete mešavinu raznih “vrsta” – od početnih ćelija koje ste imali u detinjstvu, i koje su sve imale efektivno istu DNK, nastale su familije različitih ćelija koje nose različite mutacije. Kroz stablo nasleđa, možete da vidite koje ćelije potiču od iste početne majke-ćelije, i kako su se delile nakon toga. Potpuno jednako kao kada gledate nasleđe ljudi i tražite pomoću DNK ko je kome bio baba ili deda.
Ove mutacije ne samo što utiču na funkciju ćelija, već su direktno kompetitivne. Uzmite recimo uzorak jetre, i pogledajte šta u njemu nalazite. Umesto da vidite prosto “ćelije jetre” koje sve funkcionišu na isti način, naćićete različite populacije. U nekom trenutku, recimo, neka vaša ćelija je doživela mutaciju u važnom enzimu za razaranje određenih toksina. Ta ćelija se razmnožila, i napravila “ostrvo” u vašoj jetri u kome sada žive desetine hiljada ćelija koje nose istu mutaciju, i koje su sve nesposobne da se izbore sa tim toksinom. Na sreću, odmah pored je druga familija, nastala deljenjem ćelije koja je doživela drugačiju mutaciju, i koja može da metaboliše taj toksin, ali zbog svojih oštećenja ima neke druge negativne efekte (recimo, sporije se deli, ili je osetljivija prema nekom drugom problemu).
Da ponovimo, akumulacija ovakvih mutacija, i postepeni gubitak sposobnosti koji sledi iz toga, je glavni razlog procesa starenja. I takođe je i glavni uzrok raka. Kroz generacije deobe, i kroz postepeno nakupljanje oštećenja, funkcionalnost tkiva i organa polako degradira.
Kako nastaje rak?
Kroz evoluciju, živa bića su razvila jako detaljne (i opet, redudantne) sisteme kontrole nad deobom ćelija. U normalnim uslovima, ćelija se deli samo kada je to potrebno, u skladu sa signalima koje šalju druge ćelije iz okolnog tkiva, ili koje šalju signalne centrale u telu.
Ali mutacija koja daje nekoj ćeliji sposobnost da se deli brže i lakše je pozitivno selektivna: ta ćelija, ostavljena sama sebi, će se razmnožiti dok ne potisne sve ostale normalne ćelije koje se dele sporije. Da bi se to sprečilo, naš genom sadrži niz kontrolnih mera.
Geni koji aktiviraju proces deobe (koji se u ovom kontekstu zovu “onkogeni”) su veoma strogo ograničeni, i postoji niz kontrolnih mera koji sprečavaju njihovu nepravilnu aktivaciju. Zatim to ograničenje pospešuju “anti-onkogeni,” geni kojima je funkcija da “koče” deobu ćelije i dodatno proveravaju da li je ta deoba opravdana. Zatim su tu geni koji stalno proveravaju sve druge tako što njihove produkte pokazuju na površini ćelije, gde imuni sistem može da reaguje ako se nešto zaista gadno promeni, i da onda preventivno uništi tu mutiranu ćeliju. Zatim su tu reakcije okolnih ćelija, koje sprečavaju i ograničavaju širenje na osnovu još jedne grupe gena koja reaguje na takve signale. Itd. Postoji nekoliko desetina sporednih mehanizama koji ovde rade.
Svi ti sistemi, i drugi koje ne pominjem ovde, moraju da se paralelno pokvare u istoj ćeliji, da bi nastao rak. Ćelije koje se nekontrolisano dele i koje bi mogle postati kancerozne u stvari nastaju više stotina puta SVAKOG DANA u vašem telu; ali ih ovi sistemi ubiju ili zakoče.
Što se, na žalost, desi pre ili kasnije. Što više mutacija se skupi u ćelijama, to je veća šansa da će neka od tih ćelija uspeti da prevaziđe sva ta ograničenja, i da počne da se deli nekontrolisano.
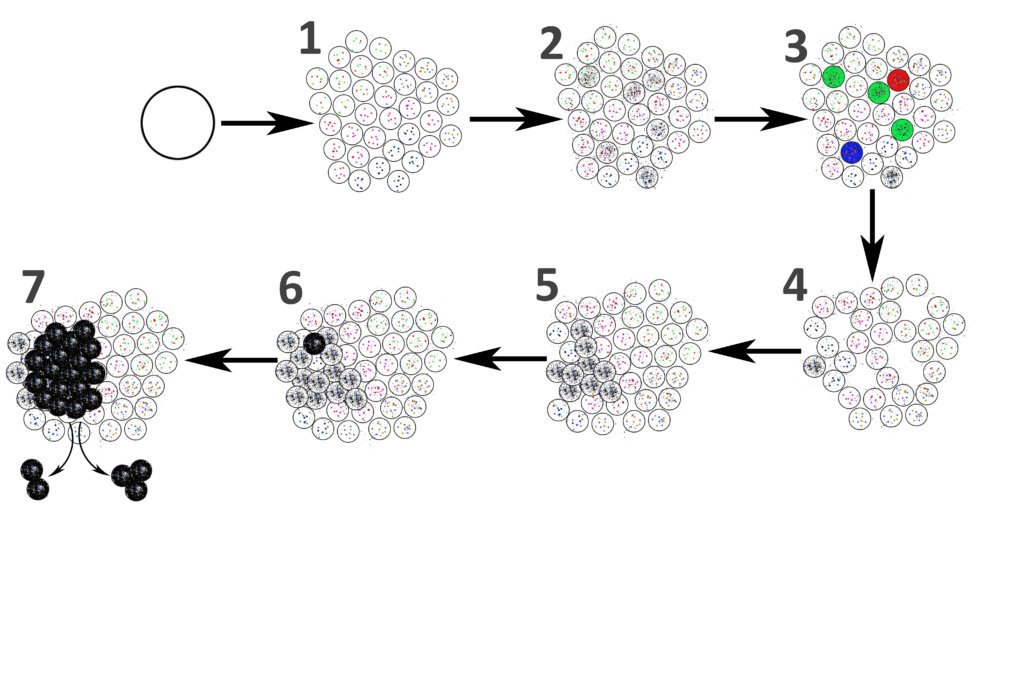
Tokom vremena sve je veći broj nakupljenih grešaka (2), dok na kraju ćelije ne počnu da umiru od tih oštećenja (3, 4). Najveći broj sam izvrši “ćelijsko samoubistvo”, apoptozu (zeleno). Neke se prosto raspadnu (nekroza, plavo), a neke naš imuni sistem prepozna i uništi (crveno). Ali ako oštećena ćelija uspe da preživi sve te prepreke, ona dođe do tačke na kojoj se deli brže od drugih i počne da se širi kroz tkivo (5). U toj deobi se nakuplja još više dodatnih mutacija, dok na kraju jedan od tih potomaka ne ubode “dobitnu kombinaciju” koja omogućava potpuno nekontrolisanu deobu (6). Tako nastaje rak, koji se zatim i širi (metastazira) od početnog tumora (7)
Imajte u vidu da su mnogi od ovih mehanizama vrlo fizički kvantitativni. Recimo, uzmite sledeći problem. Ljudi imaju određenu masu, u proseku oko 62 kg. Slonovi imaju ćelije koje nisu ništa veće od ljudskih, ali imaju masu koja se meri tonama. Oni otud imaju mnogo više ćelija – što znači da imaju mnogo veću šansu da NEKA POJEDINAČNA od tih ćelija ubode kombinaciju mutacija potrebnu za rak. Kako oni to zaobilaze?
Svi sisari imaju u svom genomu jedan važan anti-onkogen, TP53, koji sprečava nastanak raka tako što aktivira apoptozu (ćelijsko samoubistvo) ako detektuje nekontrolisano deljenje. Mutacije koje zaobilaze ili deaktiviraju TP53 su važan aspekt velikog broja kancera. Ljudi imaju dve kopije TP53 gena u svom genomu. Slonovi imaju preko 20, drastično umanjujući šansu da se ćelija otme kontroli.
Ovaj primer odmah dovodi do pitanja: zašto ljudi nemaju isto 20 kopija, ako to pomaže protiv raka?
Ako napravite ljudske ćelije koje imaju mnogo više TP53, njegova aktivnost se mnogo lakše “okine,” što dovodi do smrti ćelija čim se nešto malčice poremeti. Ćelije slonova su paralelno sa ekspanzijom TP53 adaptirale niz drugih sistema, kojim omogućava da se održava balans između mase životinje, broja ćelija, i količine mutacija. Efektivno, kod slonova je ceo sistem adaptiran tako da sa mnogo više ćelija imaju sličan nivo prosečnih genetskih oštećenja i rakova kao i ljudi. Ako bi smo pokušali da sistem iz slona adaptiramo za čoveka, čoveka bi taj sistem ubio u toku “prevencije raka.”
Ovo je vrlo slično balansu koji postoji kod imunog sistema: ako je imuni sistem preslab, čoveku stalno prete infekcije. Ako je prejak, taj čovek umire od autoimune bolesti. Isto važi i ovde. Ako je sistem zaštite od preterane deobe previše snažan, to sprečava deobu čak i kada je ona potrebna, što je jednako smrtonosno kao nekontrolisana deoba.
Što zatim vodi i do drugog pitanja: zašto bi i ljudi i slonovi (i praktično svi drugi organizmi) došli na vrlo sličan ukupan nivo mutacija, i samim tim raka? Zašto ne bi evoluirala potpuna otpornost na rak i na sva genetska oštećenja?
Iz mnogih razloga, od kojih su dva najvažnija:
Prvo, ako se zaustave procesi mutacije potpuno, zaustavlja se evolucija. Mada to jedinke spašava od raka, i usporava njihovo starenje, to takođe drastično usporava sposobnost vrste da proizvede diverzitet, i samim tim sposobnost adaptacije na promene u okruženju (nove parazite, nove infekcije, promene u klimi, itd.). Vrste koje evoluiraju ekstremnu genetsku stabilnost imaju mnogo veću šansu da izumru.
Drugo, evolucija je opaka stvar: ona adaptira sve što postoji u korist preživljavanja, bez sposobnosti da se razmatraju dugoročne posledice. Genetska oštećenja su vrlo rano u evoluciji uključena u signalne sisteme ćelija, gde regulišu metabolizam, ćelijsku aktivnost, i mnoge druge procese. Kada su ti mehanizmi postali ustanovljeni (još kod jednoćelijskih eukariota), njih je postalo jako teško, praktično nemoguće, ukloniti ili zameniti. Tako da je deo rakova i deo samog procesa starenja prosto nuzefekt činjenice da evolucija nije imala bolje osnove za gradnju signalnih sistema.
Ovo je lakše razumeti na konkretnom primeru. Kod svih eukariota postoji enzim superoksid dismutaza, kome je posao da razara najosnovniji oblik takozvanih “slobodnih radikala,” jedinjenja koja nastaju tokom normalne funkcije ćelije ali koja su jako toksična. Slobodni radikali su veliki izvor oštećenja unutar ćelije, uključujući tu i genetska oštećenja.
U toku istraživanja ovih procesa, naučnici su napravili genetskim inženjeringom miševe koji u svojim ćelijama proizvode mnogo više ovog enzima nego što je normalno. Rezultat? Ti miševi su imali mnogo manje oštećenja u ćelijama, i starili su duplo sporije; prosečan životni vek im je bio više nego dvostruko duži u poređenju sa normalnim miševima!
Ali. Isti ti miševi su takođe bili idioti u poređenju sa normalnim. Naime, da bi mozak normalno funkcionisao, neophodno je da pojedinačne nervne ćelije znaju kada treba da rastu i da prave još veza (sinapsi) sa susednim ćelijama. Uprošćeno govoreći, ako radite na nečemu, recimo rešavate matematičke zadatke, to snažno aktivira određene ćelije u određenim centrima u mozgu. Ta snažna metabolička aktivnost izaziva povećanu proizvodnju slobodnih radikala, koji oštete DNK i proteine unutar ćelije. I onda samo to oštećenje služi kao signal da se ćelija razvije i da proizvede nove kontakte, što omogućava da vaš mozak zapravo nauči tu matematiku koju vežbate. Ćelija doslovno “kaže” nešto u stilu “ah, vidim da ima mnogo štete, to znači da mora da ima mnogo metabolizma, znači ja treba sada da rastem i da pravim nove veze sa susednim neuronima.” Ako sprečite štetu, vi time sprečite i signal, i samim tim sprečite i razvoj novih veza!
Znači, imamo situaciju u kojoj je određeni nivo oštećenja nezaobilazan, ili čak kratkoročno poželjan. Ali dugoročno, vodi do starenja, povećanog rizika raka, i smrti. Do raspada sistema.
Konkretni primeri nastanka raka
Vratimo se sada na rak konkretno. Pošto su mutacije slučajne, rakovi predstavljaju široku porodicu bolesti, u kojoj isti rezultat može nastati na stotine različitih načina.
Uzmimo par pacijenata sa rakom dojki koje sam nedavno imao prilike da analiziram.
Prva pacijentkinja je imala mutacije u onkogenu BRAF (proteinu koji kontroliše signale za početak deobe ćelije), i u seriji gena koji kontrolišu jedan drugi signal, zvani PI3/AKT. Po mojoj proceni (na osnovu višestruke duplikacije relevantnog gena, pri čemu je svaka kopija imala vremena da nakupi svoje pod-mutacije), prvo se desila BRAF mutacija, koja je dala malo ubrzanje i dovela do ograničenog širenja potomaka te ćelije sa tom prvom mutacijom.
Ovo nije bio tumor! Ovo su bile ćelije koje su normalno izgledale i normalno se ponašale. Kada bi oko njih druge ćelije umrle ili ostarile, ove ćelije bi se delile da ih zamene. Pošto se dele malo brže i bolje nego normalne, potomci su se lokalno proširili (u oblasti koja verovatno nije bila veća od pola kubnog milimetra). Kroz deobu i širenje se akumulirala serija mutacija u PI3/AKT sistemu, koja bi proizvela neželjenu aktivaciju… ali se ništa nije desilo jer su te mutacije bile stopirane anti-onkogenima. Onde su se desile dve stvari: jedna jedina ćelija iz te gomilice je doživela mutaciju u anti-onkogenu PTEN, koji je glavna “kočnica” upravo za PI3/AKT – što je dozvolilo svim onim drugim nakupljenim mutacijama da odjednom počnu da deluju. Ćelija je počela naglo da se širi, proizvodeći lokalni tumor, koji je od te jedne vrlo brzo postao više miliona ćelija. U svim tim deobama, bilo je mnogo prilika za još mutacija, i jedna od njih je pogodila ERBB2 gen, jedan od glavnih “prekidača” kojim organizam naređuje ćeliji da počne da se deli – i “zaglavila” taj prekidač u uključenoj poziciji. Od toga je počeo rak.
Druga pacijentkinja je imala mnogo goru situaciju. Rođena je sa mutacijom koja je onesposobila BRCA1 gen, jedan od važnih gena koji kontrolišu popravku DNK. Rezultat je da ona u deobi određenih vrsta ćelija skuplja mnogo više mutacija nego ostali ljudi – dok prosečna osoba skupi 10 mutacija po deobi, ona bi skupljala nekoliko stotina, svaki put. Kao rezultat, nemoguće rekonstruisati kako je njen rak nastao, pošto praktično svi geni koji se pogledaju nose u sebi oštećenja i mutacije. Svaka ćelija ima toliko mnogo mutacija da je nemoguće razlučiti koje su se desile pre, a koje kasnije.
Ova razlika u mehanizmu ima jedan važan rezultat. Prva pacijentkinja je polako skupljala mutacije kroz život, i došla do ćelije koja je “ubola” uslove za rak tek u 68-moj godini života. Druga pacijentkinja je imala nesreću da se rodi sa sistemom koji joj je ubrzao skupljanje mutacija, i došla je do iste takve ćelije sa 32 godine.
Uzorci koje dobijam su anonimizovani. Ne znam da li su preživele.
Ali poenta je da svi rakovi, iako drastično različiti, ipak imaju jednu zajedničku tačku: oni su bolesti nestabilnosti genoma. Što više nestabilnosti, što više mutacija, to je veća šansa da će se ranije doći do gubitničke kombinacije koja proizvodi rak. Zbog čega su faktori rizika tako bitni.
Faktori rizika
Kod akumulacije mutacija, važna su tri faktora: snaga izlaganja, koncetracija izlaganja, i dužina izlaganja. Što je snažnije izlaganje mutagenu, to više mutacija. Što je koncentrisanije izlaganje, to će više mutacija da se desi u malom broju ćelija. I što je izlaganje duže, to je više vremena tokom koga mutacije mogu da se nakupe.
Snaga i dužina su lakši za razumevanje. Ovi faktori se mogu uprošćeno objasniti na sledeći način (sledi malo dosta osnovne matematike; da vas podsetim ovo je uprošćavanje, ali nije netačno).
Zamislite osobu koja se svaki dan izlaže nečemu što izaziva 10 z mutacija (pri čemu je “z” simbol za arbitrarnu jedinicu učestalosti mutacija). Njegovi sistemi za popravku DNK isprave svu štetu u 90% slučajeva, ali u 10% jedan z prođe. Ova osoba otud nakuplja 1 z na svakih 10 dana.
Druga osoba se izlaže 100 z mutacija dnevno. Njegovi sistemi za popravku DNK i dalje sprečavaju većinu; bliže su svom maksimalnom kapacitetu, ali i dalje ispravljaju 90% štete. Dakle, ova osoba nakuplja 10 z mutacija svaki dan.
Treća osoba se izlaže 1000 z mutacija dnevno. Njegovi sistemi za popravku DNK su potpuno nadmašeni. Oni uspeju da poprave 90 z mutacija svaki dan, slično kao kod prethodne osobe, ali ovaj čovek na kraju nakupi 910 z mutacija svaki dan.
(Neću ulaziti u dodatne komplikacije osim da napomenem da oštećenja o kojima govorimo takođe oštećuju same sisteme za popravku DNK; dakle, što više štete, to će brže da se nakuplja dalja dodatna šteta.)
Ako su ove tri osobe jednake po svemu drugom, lako je videti da će ova treća imati mnogo veću šansu da dobije rak. Veća snaga izlaganja, više mutacija, više verovatnoće.
Ali uporedite sada onu prvu osobu, koja dobija 1 z mutacija svakih deset dana, sa osobom koja samo jednom u životu bude izložena dozi od 1000 z. Dakle, poredimo 1 z na 10 dana dugoročno sa dozom od 910 z odjednom.
Ko ima veći rizik? Pa, kratkoročno, ova druga, u početku 910 puta više! Ali kroz 30 godina, prva osoba će nakupiti 1095 z oštećenja, a ova druga će ostati na 910 z.
Drugim rečima, dugotrajna mala oštećenja mogu da imaju jednako teške ili veće posledice nego velike doze oštećenja u jednom koraku.
Uzmimo primer pušenja. Smatra se da su cigarete uzrok između 15% i 30% svih rakova u današnjem svetu. Čestice duvanskog dima su mutageni, koji uđu u telo, zakače se za površinu ćelija, i onda proizvode promene na DNK. Deo ovih promena je direktan: reaktivne supstance iz čestice čađi se rastvore, prodru u ćeliju, i direktno oštete proteine i DNK. Ali deo je indirektan: oštećenja i iritacija koje izaziva čestica čađi izazivaju dodatna oštećenja.
Ovo ne izaziva rak odmah. Ako popušite jednu cigaretu, vaš rizik je mali: dobili ste jednu dozu mutacija u malom broju ćelija u plućima. Ali ako pušite svaki dan, ove doze se akumuliraju. Mutacije se dodaju jedna na drugu, i sve više ćelija u plućima ima sve veću nestabilnost. Kvarenje njihovih mehanizama znači da pluća počnu da propuštaju stvari koje ranije nisu – mutageni i oksidanti i čestica čađi počnu da prodiru u krvotok. Ovo kroz godine izazive oštećenja genetskih mehanizama (efektivno, ubrzanje starenja) u ćelijama krvnih sudova, povećavajući verovatnoću kardiovaskularnih bolesti.
Ali ne zaboravite da se ovo događa u kontekstu onih normalnih mutacija koje se dešavaju bez obzira na izlaganje. Dakle, ako vi pušite pet godina i onda prestanete, ta nakupljena šteta ostaje. I onda kroz godine i decenije, ona se propagira kroz deobu ćelija, tako da čak i 20 ili 30 godina kasnije, vi i dalje imate veću šansu da dobijete rak nego neko ko nikada nije pušio. (Ali daleko manju nego da ste nastavili da pušite, u svakom slučaju!)
Dakle, pored snage, dužina izlaganja je vrlo bitan faktor.
Koncentracija izlaganja je teža za objašnjenje, ali se može ilustrovati na dva primera.
Mezotelioma nastaje kroz izlaganje azbestu. Zrnca azbesta budu udahnuta u pluća, gde se zabodu u površinu (azbest je veoma “bodljikav” kristal). Azbest sam po sebi uopšte nije mutagen – ne izaziva mutacije ili oštećenja gena. Međutim, taj kristal azbesta svojim bodljama iritira sve okolne ćelije; buši im membrane, omogućava da stvari iz spoljnog sveta prodru u ćeliju lakše, i generalno izaziva lokalno zapaljenje. Imuni sistem dođe i napada tu česticu, ali bez efekta – osim što uspeva da još dodatno povredi okolne plućne ćelije. Ovo drastično povećava brzinu kojom se skupljaju mutacije u tim ćelijama. Dakle, iako je najveći deo pluća potpuno zdrav, imamo mikroskopske tačke na kojima se odvija velika akumulacija štete, i gde se mnogo brže ide prema kancerogenosti.
Sličnu situaciju imamo i sa radiaktivnošću. Ako uzmete grudvicu cezijuma-137 (mikroskopski malu, sto puta manju od tačke na kraju ove rečenice), i izmerite koliko ona oslobađa radijacije; i ako zatim nekog čoveka izložite tom nivou radijacije; to praktično neće imati nikakvog efekta. Svaka ćelija u telu će biti udarena sa malom pojedinačnom dozom, i one će se sa tom štetom dosta lako izboriti. Verovatno će u par ćelija ostati neki tragovi koji će se propagirati, ali rizik takvog izlaganje je smešno mali. Mnogo je veći rizik da će vas sada dok čitate ovo pogoditi meteor, nego da tako mala količina radijacije bude baš ona koja kod vas izazove rak.
Ali ako vi tu istu grudvicu cezijuma udahnete, i ako vam ona dođe u pluća, situacija je potpuno drugačija. Ćelije koje su neposredno naslonjene na grudvicu će primiti svu radijaciju iz nje, u ogromnoj dozi; dok ostale ćelije u telu neće dobiti praktično ništa. Rezultat je da ćelije u krugu od oko jednog milimetra (što uključuje milione ćelija) oko tog zrnca dobijaju doze radijacije koje nimalo nisu naivne, i koje proizvode veliki broj promena. Povrh toga, umesto da bude u pitanju jedno izlaganje, u ovom slučaju ta grudvica stoji na istom mestu više sati ili dana, i nastavlja da nanosi štetu. Rezultat je stvaranje više hiljada populacija ćelija koje sadrže veliki broj mutacija, i koje su napravile značajan korak prema kancerogenezi.
U svim tim slučajevima, osim kada je doza mutagena zaista ogromna, potrebne su godine ili decenije da od početne štete nastane rak, kroz dodatnu sporu adaptaciju i akumulaciju mutacija. Ćelija kojoj mutacije drastično promene funkciju najčešće prosto umire; opet, problem ovde su ćelije koje prežive oštećenje, koje to oštećenje prenesu budućim generacijama ćelija, a koje onda imaju priliku da se adaptiraju tim oštećenjima i da na njih dodaju druga.
Zaključak
Izbegavanje kancerogeneze je, u opštem smislu, nemoguć posao: ona je nuzefekt normalnih bioloških procesa u telu. Kako naše telo stari i akumuliše mutacije, tako se povećava verovatnoća dobijanja raka.
Ali možemo da izbegnemo spoljne mutagene. Najvažnije od svega, duvanski dim, koji je među apsolutno najgorim. Nadam se da ne moram da objašnjavam ovde da je pušenje jako loše. Alkohol takođe nije dobar, mada je u ovom pogledu mnogo manje opasan.
No, tu su i drugi: nitriti u konzervisanim namirnicama i sušenim mesima, na primer. Kao veliki ljubitelj šunki i kobasica, ovo boli. 🙂 Ali to je što je: pokušavam da ograničim upotrebu koliko je moguće.
Dalje, zagorela hrana, koja sadrži niz supstanci koje prave DNK adukte koji se teško popravljaju. Kada pečete hranu, dovoljno je da bude braon (i to sadrži mutagene, ali manje količine i manje opasnosti), ne mora da “zacrni.”
A onda imamo i one mutagene koji su sveprisutni, a koje je teže zaustaviti. Na prvom mestu je smog – iz auspuha automobila, i iz dimnjaka raznih fabrika i termoelektrana. Niko od nas ne može da smanji koliko smoga udiše, to zavisi potpuno od mesta u kome živimo. Ali ono što možemo da radimo je da podržavamo politiku i zakone koji se bore za smanjenje tog zagađenja – kroz poboljšanje javnog saobraćaja, kroz građenje čistijih fabrika i elektrana, i kroz zakone koji zahtevaju katalitičke konvertore na automobilima, kao i bolju efikasnost motora.
Radijacija, koje se ljudi često najviše boje, je u stvari relativno slab mutagen – ali ovo zavisi od vrste izlaganja. Kao što sledi iz gornjeg primera sa cezijumom-137, rizici su drastično drugačiji u slučaju izlaganje radijaciji na nivou celog tela nego u slučaju lokalizovane radioaktivnosti od progutane ili udahnute čestice radioaktivnog materijala.
Pošto niko od nas neće gutati cezijum (ili ako ga guta, neće imati izbora), ograničiću ovde priču na standardne izvore radijacije. Generalno, izlaganja dozama manjim od oko 10 mSv su nebitna, i nemaju merljivog efekta na dugoročno zdravlje. Neki naučnici veruju da ona čak mogu biti pozitivna, pošto aktiviraju sisteme za popravku DNK, i time poboljšavaju sposobnost organizma da se izbori sa drugim napadima. Ja nisam ubeđen, ali nije nemoguće. U ovu kategoriju spadaju standardni snimci pluća, zuba, preloma kostiju…
Najveća doza radijacije koju čovek može da bira da uzme je efektivno CT sken. Dotični su na granici: postoji dovoljno dokaza da itekako imaju merljive posledice, ali da su one prilično male. Moj savet je da ne izbegavate ove skenove, osim ako su zaista potpuno opcioni. Na primer, ja sam imao situaciju u kojoj sam imao CT snimak kod jednog specijaliste; a sledećeg je mrzelo da čeka da mu onaj prvi pošalje rezultate, već je hteo da me opet snima. U tom slučaju, odbio sam, jer je nepotreban rizik.
Konačno, na internetu ima mnogo priča o stvarima koje deluju “protiv raka,” i “smanjuju šansu kancera.” Iskreno, ja do sada nisam video ništa od toga što zaista ima bilo koji značajan efekt. Jako bi bilo teško uticati na nivoe mutageneze bez da to ima masu drugih efekata na organizam, većina kojih bi bili veći problemi nego što je šansa dobijanja raka.
Ali postoji jedna stvar koja je važna: fizička vežba. Nije još jasno zašto ima uticaj koji ima, ali uticaj je veliki. Recimo, ljudi koji su fizički aktivni imaju duplo manju šansu raka creva nego ljudi koji su sedentarni. Trenutno teorijsko obrazloženje je da fizička vežba utiče na niz signalnih puteva od kojih rak zavisi, i da stavlja oštećene ćelije pod metabolički stres koji dovede do njihove smrti ili do njihove prerane “aktivacije” (što znači da ih imuni sistem tada prepozna i uništi).
Čovek koji jede hamburgere i pomfrit svaki dan, ali pritom trči triput nedeljno i ide u teretanu dvaput na po pola sata – ima manju šansu raka nego čovek koji jede najbolju moguću ishranu i uzima sve moguće suplemente. Ako želite da se odbranite od raka, morate na tome da radite; i to do dobrog znoja.