Preliminarna, ali potencijalno jako važna vest iz neuronauke: moguće je da je konačno, nakon decenija potrage, otkriven zajednički mehanizam dejstva antidepresiva, što otvara vrata u potpuno novu eru tretmana i istraživanja u ovom polju. Studiju su uradili Casarotto i kolege, veliki interdisciplinarni tim, i ona je prosto tour de force – opsežna, detaljna, tehnički precizna.
Razlog zbog koga je ovo tako bitan razvoj je prost, i mnogim ljudima vrlo iznenađujuć: mi ne razumemo kako antidepresivi u stvari rade. Imamo niz lekova koji su efektivni protiv depresije, ali – verovali ili ne – niko ne može koherentno da objasni kako ili zašto. Sada imamo nešto što makar počinje da ujedinjuje niz vrlo raznolikih informacija u jedan smislen model. Potrebno je još mnogo rada, ali ovo sada otvara vrata – možemo očekivati da će ovo otkriće, ako se održi kroz dalje provere, korenito promeniti pristup tretmanima depresije (a kasnije i anksioznosti, i nekih drugih bolesti).
Ovo će biti dugačko, i komplikovano, kao što je u neurobiologiji neizbežno. Ali za one koje zanima ova oblast, ima mnogo zanimljivih informacija.
1. Istorija antidepresiva
Kako to da mi ne znamo kako antidepresivi rade? To je teško objasniti bez istorijskog pogleda.
Priča počinje od lekova protiv tuberkuloze. Početkom pedesetih godina prošlog veka, razvijen je lek isoniazid, koji se pokazao kao vrlo dobar i efektivan; ali tuberkulozu izazivaju bakterije, koje brzo evoluiraju otpornost, i naučnici su na to bili spremni. Odmah nakon ovog uspeha, počeo je razvoj niza srodnih supstanci kojima bi mogli da se “udare” otporni sojevi. Jedna takva srodna supstanca se zvala iproniazid, i pokazala se takođe efikasnom protiv tuberkuloze, mada sa zanimljivim nuspojavama: mnogi pacijenti su izvestili da su tokom tretmana imali osećaj euforije, da su bolje spavali nego ikad ranije, i da im se poboljšao apetit.
Psihijatri, koji tada praktično nisu imali lekove koje su mogli da prepišu, su uhvatili iproniazid i pokušali da ga upotrebe protiv kliničke depresije – i u tome su bili uspešni. U kliničkim studijama se pokazalo da kod velikog broja obolelih od depresije, iproniazid delimično ili potpuno eliminiše simptome (opisano u Psychiatr Res Rep Am Psychiatr Assoc 1957;8:129-41.), mada uz opasnost proizvodnje obrnutog problema (manija). Iproniazid je otud bio prvi antidepresiv ikada proizveden; ali kada je ubodena ova dobitna kombinacija, ubrzo je proizveden niz sličnih lekova.
Naravno, odmah je postavljeno pitanje šta ti lekovi u stvari rade, i nađeno je da deluju kao inhibitori monoamin oksidaze (MAOI). Šta ovo znači?
Monoamini su velika kategorija supstanci, od kojih neke naše telo koristi za slanje signala od jedne ćelije do drugih. Za mnoge ste skoro sigurno čuli i ranije. Kada vas nešto uplaši, žlezde na vrhu vaših bubrega u vaš krvotok puste monoamin adrenalin. U mozgu, crevima, i na drugim se široko koriste monoamini dopamin i serotonin.
Za signale u telu je važno kontrolisati kada počnu (kada se signalni molekul izbaci), ali i kada se ugase (kada signalni molekul treba da prestane da deluje). Gašenje signala se vrši tako što se molekul ili povuče iz cirkulacije (kroz takozvane transportne proteine), ili tako što se signalni molekul uništi. Monoamin oksidaza je enzim koji je bitan za ovaj drugi pristup: ona oksidiše monoamine, i time zaustavlja njihovo dalje dejstvo.
MAOI lekovi poput iproniazida usporavaju monoamin oksidazu, što znači da monoamini duže traju, pa samim time duže u telu opstaje signal koga oni proizvode. Iz ove obzervacije je izgrađena hipoteza da depresiju uzrokuje nedostatak monoamina – i da se bolest može lečiti tako što se količina monoaminskih signala poveća. Ova ideja je postala još jača kada je uočeno da jedan rani lek protiv visokog pritiska (reserpin) smanjuje nivo monoamina u mozgu, a kod nekih ljudi pritom izaziva (mada obično samo privremeno) depresiju.
Sledeći veliki uspeh u ovom polju je nastao na sličan način, iz slučajne obzervacije kod lekova koji su bili namenjeni za nešto drugo. Naime, u pokušajima da se napravi lek protiv alergije, proizveden je hlorpromazin, za koga se ispostavilo da deluje jako dobro kao antipsihotik (u lečenju bolesti poput šizofrenije). U daljem razvoju, iz hlorpromazina je napravljen imipiramin, za koga je uočeno da ima snažno antidepresivno dejstvo. (Od imipiramina je zatim proizvedena cela lista sličnih supstanci, takozvanih “tricikličnih antidepresiva,” ili TCA.)
Trebalo je dosta vremena da se otkrije da je najveće dejstvo TCA lekova to što ometaju transportne proteine koji uklanjaju monoamine iz cirkulacije. Ovo se savršeno uklopilo u hipotezu – eto, opet, kad pojačamo ili produžimo monoaminski signal, dobijemo olakšanje depresije.
No, i MAOI i TCA imaju dosta nezgodne i komplikovane nuspojave. Monoamini ne deluju samo u mozgu, već i u ostatku tela. Mnoge namirnice, na primer, sadrže tiramin – supstancu koju monoamin oksidaza u našem stomaku brzo uništi, ali koja može da izazove smrtonosno visok krvni pritisak kod ljudi koji uzimaju MAOI. Ljudi koji uzimaju TCA često pate od zatvora, pospanosti, i problema sa pamćenjem. Itd.
Zbog toga je ogromna količina rada u medicinskoj hemiji decenijama bila usmerena u pravcu namernog razvoja boljih lekova protiv depresije, koji tačnije deluju na monoaminski balans u mozgu. Težak projekt, koji je zahtevao ogromnu količinu rada i truda (i novca) – nije lako napraviti nešto što deluje na mozak, a da to dejstvo bude precizno i dobro.
Ali taj rad je na kraju tokom krajem prošlog veka kulminirao u razvoju takozvanih SSRI i SNRI lekova, supstanci koje vrlo specifično zaustavljaju rad transportnih proteina, i povećavaju koncentraciju monoamina baš u okviru mozga, sa minimumom “udara” na druge sisteme u telu. Ovo su danas neki od najšire prepisivanih lekova u svetu, poput fluoksetina (Prozac) ili sertralina (Zoloft). Ovi lekovi su vrlo uspešni – ali su usput razotkrili, na užas većeg dela profesije, da osnovna hipoteza o monoaminima i depresiji u stvari nije tačna.
2. Priča postaje komplikovanija
Naime, pored transporta ili uništavanja signalnih molekula, naše telo kontroliše signale i na treći način: receptorska homeostaza. Signali generalno, uključujući tu i monoaminske, imaju dva dela: pošiljaoca koji oslobađa signalni molekul, i ćeliju-primaoca koja na sebi ima receptore koji taj molekul prihvataju.
Jedan neuron oslobodi serotonin, i taj serotonin onda odpluta do drugog neurona, gde se veže za specijalan protein, serotoninski receptor. Taj receptor onda aktivira sisteme unutar prijemne ćelije.
Ali ako se oslobađa previše serotonina, ili ako signal traje suviše dugo (kao što je slučaj kod ljudi koji uzimaju antidepresive), ćelija primalac pokušava da se vrati u normalu, i to radi tako što sa svoje površine uklanja receptore! Povećanje signala time postaje beznačajno, pošto nema receptora da taj povećani signal detektuju.
Kada su SSRI i SNRI lekovi izašli na tržište, ubrzo je pokazano da se upravo ovo događa i kod depresivnih ljudi. Nivo serotoninskih i/ili norepinefrinskih signala raste u početku, ali onda tokom sledećih par meseci opada, i u roku od oko šest meseci postaje isti kao što je bio pre nego što se počelo sa uzimanjem leka.
(Ovo proizvodi i jedan ozbiljan problem sa ovakvim lekovima. Naime, ne sme se naglo prestati sa uzimanjem, jer onda serotoninski signal naglo opadne, a ćelije-primaoci i dalje imaju sniženi broj receptora. Taj manji nivo signala nije dovoljan da aktivira smanjen broj receptora, i to dovodi do gubljenja signala na nivou koji može biti opasan po život. Kod prestanka korišćenja ovakvih lekova, potrebno je polako smanjiti dozu, da bi se nivo monoamina vratio nazad u normalu postepeno, i da bi se dalo vremena ćelijama da vrate u normalu i broj receptora.)
Pitanje je ovde očigledno: ako je depresija problem nedovoljno snažnih monoaminskih signala, kako to da se depresija ne vrati nazad čim se ćelije adaptiraju i broj receptora umanji? Ali ljudi mogu da budu na antidepresivima godinama, bez snažnih gubitaka u efikasnosti.
Zatim je tu i potpuno nejasna obzervacija u vezi dopamina. S jedne strane, postoje mnogi lekovi koji povećavaju količinu dopamina u mozgu, i koji nemaju nikakvog efekta na depresiju. S druge strane imamo bupropion, koji povećava samo dopamin, bez doticanja serotonina; i koji je pritom dosta snažan i efektivan antidepresiv. Zašto bi povećanje dopamina bilo neefikasno kada se postigne kroz sve te razne lekove, ali postaje antidepresivno ako se postigne bupropionom?
Kao dodatni udarac, niz studija je namerno oborio nivo serotonina u mozgu učesnika na razne načine. Kod ljudi bez istorije depresije, ovo nije imalo nikakvog efekta! Kod ljudi sa istorijom depresije, ovo bi proizvelo privremeno povećanje depresivnih simptoma – ali onda bi ovaj efekt nestao, iako je nivo serotonina ostao i dalje nizak. Svi ti podaci su polako oborili početnu jednostavnu hipotezu po kojoj manje serotonina (ili drugih monoamina) kauzalno proizvodi depresiju.
Šta je onda uzrok depresije? Postojalo je mnogo ideja, sa raznovrsnim ali generalno pojedinačno slabim dokazima. Nećemo ovde pričati o svima, ali izdvojićemo jednu povezanu grupu hipoteza koja je bitna za novo otkriće o kome govorimo.
Naime, uočeno je da se kod ljudi koji uzimaju antidepresive povećava takozvana “plastičnost” mozga: sposobnost nervnih ćelija da razviju nove veze sa drugim neuronima (sinapse), i takođe sposobnost da uklone nepotrebne veze. Ovo je usko povezano sa dejstvom proteina BDNF (brain-derived neurotrophic factor), koji sam deluje kao signal u mozgu, i koji ima i svoj receptor (zvani TrkB). Uočeno je da mnoge nepovezane stvari za koje se zna da smanjuju depresiju – fizička vežba, antidepresivi, restrikcija kalorija, intelektualna stimulacija – takođe povećavaju i nivoe BDNF signaliranja u mozgu.
Ali tu nije bila jasna veza, i sasvim je bilo moguće da je to nuzefekt nečeg drugog – recimo, da promene u monoaminskom signaliranju dovode do povećanja proizvodnje ili aktivnosti BDNF. A bilo je još mnogo drugih hipoteza koje su imale jednako snažne dokaze. Tako da je ovo bila samo jedna opcija među mnogim.
3. Nova studija: antidepresivi raznih kategorija direktno vezuju TrkB i time povećavaju BDNF signale
U upravo objavljenoj studiji se govori o… pa, mnogo stvari. Između ostalog, veliki deo studije se bavi interakcijom između TrkB i holesterola u ćelijskim membranama neurona. To je posebna priča, takođe bitna, ali tangencijalna za poentu koju ovde treba obraditi, i prekomplikovana za ovaj već predugačak tekst. Ostavljam to za neki drugi put.
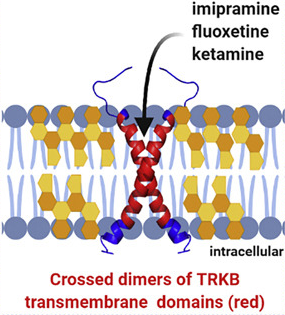
Ono što je bitno je sledeće: autori studije su pokazali da TrkB, receptor koji detektuje BDNF, formira kompleks u ćelijskim membranama. U tom kompleksu, dva TrkB molekula se povežu i “ukrste” u delu koji se nalazi UNUTAR same membrane (što je najteži deo za posmatranje i merenje većinom naučnih metoda). I na tom ukrštenom delu se formira mesto za koje se vezuju razni antidepresivni lekovi.
Ovo uključuje SSRI lekove kao što je fluoxetin, TCA lekove kao što je imipiramin, pa čak i MAOI kao što je moclebemide. Dakle sve potpuno različite klase lekova vezuju isti molekul na istom mestu. I kada se lek veže za TrkB kompleks, on ga stabilizuje i dovodi istovremeno do povećane efektivnosti BDNF signala ali i do povećane sposobnosti tog kompleksa da opstane na površini ćelije. Što znači da se makar delimično kontrira homeostatskim mehanizmima koji inače uklanjaju receptore kada se signal veštački poveća.
Onda su testirali S,S-hidroksinorketamin, metabolit ketamina za koga se pokazalo da snažno deluje protiv depresije, ali na do sada nepoznat način – jer nema ama baš nikakve veze sa monoaminima ni na koji način. I, pogodite šta? S,S-hidroksinorketamin takođe vezuje istu tačku TrkB kompleksa, sa istim efektima na BDNF signal.
Drugi psihijatrijski lekovi koji ne deluju kao antidepresivi nemaju specifičan afinitet vezivanja za TrkB.
Autori studije su zatim analizirali strukturu tog vezujućeg dela TrkB proteina, i pronašli mutante koji uništavaju ovo vezivanje bez gubitka funkcije. Drugim rečima, mutirani proteini i dalje vrše svoju osnovnu funkciju normalno, samo što više nisu u stanju da vežu antidepresivne lekove.
Na osnovu toga, proizveli su transgeničke miševe koji umesto normalnog TrkB imaju ove mutirane verzije. Mada miševi ne dobijaju istu vrstu depresije kao ljudi, moguće je kod njih na razne načine izmeriti nivo depresivnosti ili optimizma. Studija koristi više metoda, ja ću ovde opisati samo jedan: miševi se stave u cilindar sa vodom, u kome oni odmah počnu da plivaju i da traže način da se izvuku iz vode. Optimistični miševi se trude i do nekoliko minuta; depresivni miševi (recimo oni koji žive sami i pate od usamljenosti) odustanu brzo i prosto počnu da nemoćno plutaju.
Naši ljudski antidepresivi deluju i na miševe: ako im se da antidepresiv, miševi u proseku pokušavaju da se izvuku iz cilindra mnogo duže nego inače. Ali… na miševe sa mutacijama u TrkB, ovi lekovi nisu imali nikakvog efekta! Iako su u nervnim ćelijama tih miševa prisutni potpuno normalni oblici proteina za koje se smatralo da su meta antidepresiva kroz sve ove decenije (normalna monoamin oksidaza, normalni transportni proteini). Što je snažna indikacija da je mehanizam dejstva antidepresiva u stvari baš ovo vezivanje za TrkB kompleks.
4. Šta sada sledi?
Ovo je jedna studija koja, ma koliko dobro urađena, predstavlja samo prvi predlog hipoteze. Rezultati su ozbiljni, dobro podržani, i tehnički izgledaju snažno. Ali i dalje je potrebna dodatna provera – i možete se kladiti da će više drugih grupa da se usmeri upravo na to. Ako hipoteza preživi dalje testove, i ako se pokaže da je TrkB kompleks zaista centralna osovina dejstva antidepresiva… ovo će biti prekretnica u našem razumevanju depresije, i niza drugih mentalnih bolesti.
Povrh činjenice da nam ovo daje direktnu metu koju možemo koristiti za razvoj bolje ciljanih lekova, ovo je takođe i prozor kroz koga možemo da posmatramo vrlo kompleksne i slabo poznate aspekte funkcije nervnih ćelija. Naime, male su šanse da su svi ovi raznoliki lekovi slučajno povezani sa monoaminima. Mnogo je verovatnije da se radi o kompleksnoj interakciji, u kojoj efekti (čak i privremeni) na monoaminsko signaliranje utiču na balans depresije u sadejstvu sa promenom BDNF/TrkB signala. Mozak je komplikovan organ, i sve je uvek komplikovanije nego što izgleda na prvi pogled.
Ali uz sva ta ograničenja, ovo zavređuje optimizam. Ovakvi rezultati proizvode novu nadu – što je samo po sebi antidepresiv, zar ne? 🙂